Roturas de recipientes, BLEVE. Riesgos de los gases en recipientes cerrados. Explosión por la Expansión de los Vapores de un Líquido en Ebullición.
RIESGOS DEL TRANSPORTE DE GASES
Gases en el transporte de mercancías peligrosas
Al margen del tipo de gas en concreto de que se trate, todos los gases, presurizados, licuados o criogénicos, presentan unos riesgos determinados que siguen las leyes físicas de los gases, y que son en líneas generales el aumento de presión del gas y la resistencia del envase que lo contiene, así como la influencia de la temperatura en la que se encuentran, que afectará al equilibrio general del sistema.
Resumiendo, diremos que:
1º.- Los gases se expanden cuando se calientan, y este calentamiento produce un aumento de la presión del recipiente que puede dar lugar como resultado la fuga o rotura del envase.
2º.- Los recipientes pueden fracturarse como resultado de las llamas de un foco externo al que estén expuestos, debido a la pérdida de resistencia del material con que están fabricados.
3º.- Los recipientes que contienen gas presurizado únicamente, el efecto del aumento de la temperatura, conllevará al aumento de la presión.
Para verlo más claro, estudiaremos un ejemplo:
- Supongamos un recipiente de 1 m3 de un gas comprimido a 50 Kg/cm2 y a 20 ºC de temperatura. Si por efecto de un incendio se le aplica un aumento de la temperatura hasta 100ºC, aplicando las Leyes físicas de los gases:
- Por lo tanto la presión medida debería ser de 64,94 Kg/cm2. Este aumento de presión, si lo calculamos para diferentes incrementos de temperatura, llegaríamos a valores superiores a la resistencia del envase. Por lo tanto, las válvulas de sobre presión deben estar calculadas para que sean capaces de aliviar el exceso de presión para que no llegue a alcanzarse la presión de rotura del envase.
→ En el caso de los gases licuados, incluidos los criogénicos, tienen un comportamiento bastante más complicado, puesto que el resultado final de un calentamiento es el resultado neto de la combinación de tres efectos.
- Primero, la fase gaseosa está sujeta a los mismos principios físicos antes mencionados.
- En segundo lugar, el líquido, cuando se calienta tiende a dilatarse comprimiendo más la fase gaseosa.
- Y finalmente, la presión de Vapor del líquido aumenta con la temperatura, dando como resultado un aumento de la cantidad en fase gaseosa. La combinación de los tres elementos, lleva a que con menor diferencia de temperatura, se consiga un aumento bastante superior de la presión interior del envase.
Puede darse el caso de un aumento de presión mucho más grave, si la dilatación de la fase líquida hace que el recipiente quede totalmente lleno de líquido, (condensación de la fase gaseosa); si esto sucede, cualquier pequeña cantidad de calor adicional producirá un aumento enorme de la presión.
Por ello, es de suma importancia no introducir mayor cantidad de gas en fase líquida de la que pueda contener el recipiente, dejando así una cámara suficientemente grande de fase gas para que cuando alcance el recipiente la temperatura ambiente no quede sobrepresurizado.
Roturas de recipientes, BLEVE
Las siglas "BLEVE" vienen de la definición americana "Boiling Liquid Expanding Vapor Explosion" que traducido significa:
"Explosión por la Expansión de los Vapores de un Líquido en Ebullición"
Este temido fenómeno, vale la pena estudiarlo más en profundidad, ya que para que ocurra, se deben dar unas situaciones muy concretas.
Como su definición indica, se precisa de un líquido confinado en un recipiente, que sea capaz de emitir vapores al calentarse.
Será el caso de todos los gases licuados, independientemente de que sean inflamables o no, los cuales en su almacenamiento dentro de un tanque cerrado, siempre están a una temperatura superior a la de su punto de ebullición, y a una presión superior a su presión de Vapor a temperatura ambiente.
Si por cualquier razón, se produce una bajada de presión de la fase gaseosa, el líquido empezará a evaporar gas para así conseguir su equilibrio. De igual manera, si calentamos la fase líquida, haremos aumentar la presión de vapor del líquido.
Teniendo en cuenta estos parámetros, para que se produzca el BLEVE, son necesarias tres condiciones:
Teniendo en cuenta estos parámetros, para que se produzca el BLEVE, son necesarias tres condiciones:
1. Que la fase líquida esté sobrecalentada.
2. Que se produzca una bajada brusca de presión en la fase gas.
3. Que se den las condiciones de presión y temperatura que consigan la ebullición de toda la masa líquida de forma instantánea.
Intentaremos describir cada una de estas condiciones.
En primer lugar decíamos que necesitamos un líquido sometido a presión y sobrecalentado.
- Todos sabemos que todos los líquidos tienen una temperatura en la cual empiezan a hervir y a emitir vapores, es la llamada Temperatura de Ebullición, pues bien, ésta temperatura de ebullición varía en función de la presión en la que se ve sometido, de manera que por ejemplo el agua, cuya temperatura de ebullición es de 100ºC, si la sometemos a presión, no hervirá hasta alcanzar temperaturas superiores.
En el caso de los gases licuados, podemos decir que al aumentar la presión para almacenarlos, aumentamos su punto de ebullición, con lo cual si reducimos su presión a presión atmosférica, toda la fase líquida pasaría a fase de gas, hervirá y se evaporará a temperatura ambiente.
- Por tanto son líquidos que se les puede denominar "sobrecalentados".
Decíamos, que para que se produzca la BLEVE, era necesaria una bajada brusca de la presión del recipiente.
- Esta bajada brusca se puede dar de diferentes maneras, como puede ser el fallo de la resistencia mecánica de recipiente por un golpe o punción, por fallo de resistencia mecánica por calentamiento excesivo del metal del que está construido, o incluso por la apertura de una válvula sobredimensionada que libere incontroladamente una cantidad excesiva de presión.
Para entenderlo mejor, debemos estudiar las gráficas en las que se relacionan la presión con la temperatura; en estas curvas, están señaladas las líneas límite de sobrecalentamiento (Superheat limit locus), que son específicas para cada gas en concreto.
Cabe señalar, que la violencia de la BLEVE, viene dada por el tipo de gas que contiene ( en el caso del propano líquido, una unidad de volumen de propano líquido es capaz de generar 280 unidades de volumen de vapor; para el caso de líquidos inflamables, la vaporización súbita en caso de BLEVE suele ser del orden del 10% ; para los gases criogénicos suele estar en orden del 25 %; y del orden de 50% para gases no criogénicos), y por la diferencia entre la presión de vapor del punto donde se halle en equilibrio en aquel momento y la correspondiente presión del punto de corte de la línea de sobrecalentamiento.
Es curioso comprobar, que las explosiones BLEVE son más violentas si la presión y temperatura son inferiores a la del punto crítico, aunque si bien es cierto, que la energía acumulada en la zona del punto crítico sea mayor.
Es importante tener en cuenta, que es muy difícil calentar una cisterna en la zona donde se encuentra la fase líquida, ya que el calor es absorbido por el líquido y disipado por toda la cisterna (actúa como refrigerante)y actúa como regulador térmico. En el caso del Propano, las válvulas de sobrepresión empezarán a descargar cuando la temperatura del líquido alcance los 50 o 60ºC, con lo que la temperatura del metal está muy por debajo de su punto de rotura.
Por el contrario, si se calienta el metal por la zona de la fase de gas, como el gas es mal conductor térmico, será el metal el que soporte todo el aumento de la temperatura. Se da el caso, en la mayor parte de las BLEVES, que la ruptura se produce por la parte metálica de la fase gas, y se caracteriza por una deformación del metal con la consiguiente reducción del espesor y aparición inmediata de una grieta longitudinal que crece progresivamente hasta que alcanza una magnitud crítica. En este punto, el metal se hace frágil y se rompe en dos o más pedazos.
Se han estudiado ampliamente las rupturas térmicas y sus consecuencias, sobre todo cuando están implicados los contenedores bajo presión.
Es importante tener en cuenta, que es muy difícil calentar una cisterna en la zona donde se encuentra la fase líquida, ya que el calor es absorbido por el líquido y disipado por toda la cisterna (actúa como refrigerante)y actúa como regulador térmico. En el caso del Propano, las válvulas de sobrepresión empezarán a descargar cuando la temperatura del líquido alcance los 50 o 60ºC, con lo que la temperatura del metal está muy por debajo de su punto de rotura.
Por el contrario, si se calienta el metal por la zona de la fase de gas, como el gas es mal conductor térmico, será el metal el que soporte todo el aumento de la temperatura. Se da el caso, en la mayor parte de las BLEVES, que la ruptura se produce por la parte metálica de la fase gas, y se caracteriza por una deformación del metal con la consiguiente reducción del espesor y aparición inmediata de una grieta longitudinal que crece progresivamente hasta que alcanza una magnitud crítica. En este punto, el metal se hace frágil y se rompe en dos o más pedazos.
Se han estudiado ampliamente las rupturas térmicas y sus consecuencias, sobre todo cuando están implicados los contenedores bajo presión.
En resumen, podemos decir que si surge una ruptura violenta (BLEVE), es probable que, aproximadamente en los primeros 150-180 metros desde un contenedor de GLP, se experimente una bola de fuego y calor radiante. Los siguientes 150-180 metros, (hasta un radio de 370 m.) experimentan calor radiante desde la bola de fuego.
Los fragmentos del contenedor, en ocasiones de gran tamaño, pueden ser trasladados a más de 370 m y causar incendios más allá de dicho perímetro.
Los fragmentos del contenedor, en ocasiones de gran tamaño, pueden ser trasladados a más de 370 m y causar incendios más allá de dicho perímetro.



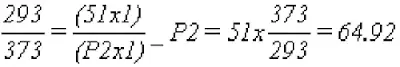










0 Comentarios
Ayúdanos a mejorar nuestros contenidos!!!
Deja tu comentario: