Tema disponible en pdf: El calor de descomposición. Reacciones exotérmicas. Tipos de reacciones de descomposición. Descomposición térmica o termólisis. Ecuaciones para la descomposición térmica. Diferencias entre descomposición y combustión. Aplicaciones prácticas.
Topic available in pdf: The heat of decomposition. exothermic reactions. Types of decomposition reactions. Thermal decomposition or thermolysis. Equations for thermal decomposition. Differences between decomposition and combustion. Practical applications.
CURSO ONLINE QUÍMICA DEL FUEGO
La energía química: Calor de descomposición
Calor de descomposición.
᳓ El calor de descomposición:Es desprendido por la descomposición de compuestos que requieren la presencia de calor durante su formación.
Como la mayor parte de los compuestos químicos se producen por reacciones exotérmicas, el calor de descomposición no es un fenómeno muy común.
Los compuestos formados a partir de reacciones endotérmicas son frecuentemente inestables.
- ᳓ Cuando comienza la descomposición por calentamiento por encima de la temperatura crítica, dicha descomposición continúa por sí sola con liberación de calor.
El nitrato de celulosa es muy conocido por su tendencia a descomponerse con liberación de peligrosas cantidades de calor.
La acción química responsable del efecto de muchos de los explosivos militares o comerciales es la rápida descomposición de un compuesto inestable.
Tipos de reacciones de descomposición
Las reacciones de descomposición son de tres tipos:
- Reacción de descomposición térmica: la termólisis es la descomposición debido al calor.
- Reacción de descomposición electrolítica: la electrólisis es la descomposición debido a la electricidad.
- Reacción de fotodescomposición: la fotólisis es la descomposición debida a la luz.
Descomposición térmica o termólisis
La descomposición térmica, o termólisis, es un proceso químico de descomposición debido a las altas temperaturas.
᳓ La temperatura a la que una sustancia se descompone químicamente se denomina temperatura de descomposición.
Se requiere calor para romper los enlaces químicos en la sustancia que se descompone; por tanto, la reacción es frecuentemente endotérmica.
A altas temperaturas se producen reacciones de descomposición térmica. Mientras se descomponen en productos, los reactivos absorben mucha energía. El reactivo es el químico de partida. Se descompone en partículas más simples.
Ecuaciones para la descomposición térmica
Solo hay un reactivo en una reacción de descomposición térmica, pero dos o más productos.
AB → A + B
La molécula original (reactivo) es AB, mientras que las moléculas resultantes son A y B.
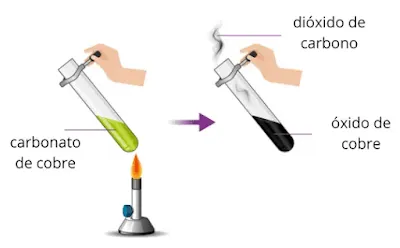
Por ejemplo, cuando se calienta el carbonato de cobre, se descompone en óxido de cobre y dióxido de carbono.
El carbonato de cobre es una sustancia verde, mientras que el óxido de cobre es negro. Durante la reacción, el color cambia de verde a negro. El agua de cal, que cambia de clara a turbia, se puede usar para identificar el dióxido de carbono creado.
La ecuación sería:
Carbonato de cobre → Óxido de cobre + Dióxido de carbono
El símbolo de la ecuación para esta reacción es:
CuCO₃ (s) → CuO (s) + CO₂ (g)
Diferencias entre descomposición y combustión
La descomposición térmica, o termólisis, es un proceso químico de descomposición causado por el calor. A altas temperaturas, los reactivos absorben mucha energía. La temperatura a la que una sustancia se descompone químicamente se denomina temperatura de descomposición.
La combustión es un proceso químico en el que una sustancia reacciona rápidamente con oxígeno o en presencia de oxígeno y emite calor y luz en forma de llama.
Se dice que una reacción de descomposición es espontánea si ocurre sin el uso de energía. Las reacciones exotérmicas entre reactivos, generalmente un combustible y un oxidante, se conocen como reacciones de combustión.
La descomposición y la combustión son reacciones químicas que descomponen materiales complejos en moléculas más pequeñas.
Un reactivo produce dos o más productos en las reacciones de descomposición. Las fuentes de energía como el calor, la luz o la electricidad descomponen el reactivo.
Las reacciones de combustión ocurren cuando los compuestos reaccionan rápidamente con el oxígeno y requieren una fuente de ignición, como una llama.
La descomposición por calor de las moléculas en radicales libres es la primera etapa de una reacción de combustión. Luego, los radicales libres proceden a reaccionar con las moléculas en lo que se conoce como pasos de propagación, que producen nuevos radicales libres y continúan la reacción.
Finalmente, están los pasos de terminación, que incluyen la formación de moléculas estables como el agua mediante la combinación de radicales libres. Entonces, en una reacción de combustión, las moléculas se descomponen térmicamente en radicales libres, lo que mantiene la reacción, así como una combinación de radicales libres, que produce moléculas estables y lleva la reacción a su fin.
Aplicaciones prácticas
La descomposición térmica afecta una variedad de eventos en el mundo real.
Las huellas dactilares son una de las cosas que se ven afectadas. Cuando alguien toca algo, deja un residuo en sus dedos. Si sus dedos están sudorosos o tienen aceite, el residuo incluirá una gran cantidad de productos químicos.
De Paoli y sus colegas investigaron el deterioro térmico de componentes específicos de huellas dactilares. Cuando se expusieron al calor, las muestras de aminoácidos y urea comenzaron a descomponerse a 100 °C, mientras que las muestras de ácido láctico comenzaron a descomponerse a aproximadamente 50 °C.
La descomposición de las huellas dactilares es importante en la profesión forense, ya que estos componentes son necesarios para realizar más pruebas.