CONCEPTOS FUNDAMENTALES SOBRE MAGNITUDES FÍSICAS
QUÍMICA DEL FUEGO PARA BOMBEROS
Temario específico bomberos
1. Concepto de Calor (q).
2. Concepto de temperatura.
3. Diferencia entre calor y temperatura.
4. Escalas de temperatura.
5. Medición de temperaturas: termómetros.
6. Estructura atómica de la materia.
2. Concepto de temperatura.
3. Diferencia entre calor y temperatura.
4. Escalas de temperatura.
5. Medición de temperaturas: termómetros.
6. Estructura atómica de la materia.
1. CONCEPTO DE CALOR (q)
La energía calorífica, como toda energía capaz de producir trabajo, es una manifestación de energía que es capaz de producir calor, es decir es un tipo de energía como puede ser la eléctrica, la mecánica, la química, etc.
Por ello, el calor es consecuencia de los movimientos de las moléculas, las cuales, en el seno de la materia, se entrechocan constantemente.
Cuanto mayor es la energía cinética de las moléculas, mayor es la violencia de los choques entre ellas y el calor desprendido. Todo es debido a que los cuerpos tienden a adoptar la forma de menor energía, cediendo el exceso que pueda tener o generar al ambiente que le rodea.
Podemos medir el calor, pues los cambios de estado calorífico de los cuerpos se ponen de manifiesto por medida de su temperatura o bien de su estado físico (como por ejemplo la dilatación de los cuerpos, cambios de estado, etc...).
Se llama calor de combustión de una sustancia:
Al calor que se desprende cuando reacciona con el oxigeno, a volumen y presión constante, dicho calor tiene gran importancia, por ser el proceso más importante por el cual se genera energía calorífica.
Dicho calor puede medirse por medio de una bomba calorimétrica, la cual se basa en la transmisión de calor de una sustancia a una cantidad determinada de agua, cuando se calienta la misma, al elevarse su temperatura.
La cantidad de calor varía según la temperatura inicial del agua, se toma como patrón el intervalo entre 14,5 y 15,5º (más exacto).
Por ello, el calor es consecuencia de los movimientos de las moléculas, las cuales, en el seno de la materia, se entrechocan constantemente.
Cuanto mayor es la energía cinética de las moléculas, mayor es la violencia de los choques entre ellas y el calor desprendido. Todo es debido a que los cuerpos tienden a adoptar la forma de menor energía, cediendo el exceso que pueda tener o generar al ambiente que le rodea.
Podemos medir el calor, pues los cambios de estado calorífico de los cuerpos se ponen de manifiesto por medida de su temperatura o bien de su estado físico (como por ejemplo la dilatación de los cuerpos, cambios de estado, etc...).
Se llama calor de combustión de una sustancia:
Al calor que se desprende cuando reacciona con el oxigeno, a volumen y presión constante, dicho calor tiene gran importancia, por ser el proceso más importante por el cual se genera energía calorífica.
Dicho calor puede medirse por medio de una bomba calorimétrica, la cual se basa en la transmisión de calor de una sustancia a una cantidad determinada de agua, cuando se calienta la misma, al elevarse su temperatura.
La cantidad de calor varía según la temperatura inicial del agua, se toma como patrón el intervalo entre 14,5 y 15,5º (más exacto).
El calor de combustión de un material:
Es la cantidad de calor liberado por unidad de volumen y masa, cuando este se quema completamente. Su unidad es la caloría o joule según hablemos de energía térmica o mecánica.
Caloría:
Es la unidad principal del calor, que es el calor necesario para calentar un gramo de agua a 1ºC. Para una mayor exactitud se toma el agua a la temperatura del intervalo anterior.
También es la cantidad de calor equivalente a 4,186 julios (relación de la energía térmica y mecánica, trabajo realizado para enfriarse). Como dicha unidad es muy pequeña se utilizan otras como la kilocaloría (1.000 calorías) o la megacaloría (1.000.000 calorías o 1.000 kilocalorías).
También es la cantidad de calor equivalente a 4,186 julios (relación de la energía térmica y mecánica, trabajo realizado para enfriarse). Como dicha unidad es muy pequeña se utilizan otras como la kilocaloría (1.000 calorías) o la megacaloría (1.000.000 calorías o 1.000 kilocalorías).
Calor especifico (ce):
Es la cantidad de calor necesaria para calentar en 1ºC la unidad de masa (1 gr.) de un cuerpo o sustancia.
Difiere de una sustancia a otra y la cantidad tiene relación con la naturaleza del cuerpo.
La relación con el calor es: q = ce ⋅ Masa ⋅ (t2-t1).
Para el caso del agua, si esta se encuentra en estado sólido (hielo) entonces ce = 0,502 cal/gr.
Y si está en forma líquida ce = 1 cal/gr.
Difiere de una sustancia a otra y la cantidad tiene relación con la naturaleza del cuerpo.
La relación con el calor es: q = ce ⋅ Masa ⋅ (t2-t1).
Para el caso del agua, si esta se encuentra en estado sólido (hielo) entonces ce = 0,502 cal/gr.
Y si está en forma líquida ce = 1 cal/gr.
Calor latente:
Es la cantidad de calor absorbido o que se desprende cuando se produce un cambio de estado en la materia. Para el caso del agua, tenemos que el calor latente de fusión es de 80 cal/gr.
Y el calor latente de vaporización es de 537 cal/gr.
La propagación del calor puede realizarse por alguno de los siguientes procedimientos:
Y el calor latente de vaporización es de 537 cal/gr.
La propagación del calor puede realizarse por alguno de los siguientes procedimientos:
Calor por Conducción:
Es la producida por el contacto directo entre las moléculas de una sustancia con otra, existiendo un gradiente de temperatura entre ambos (diferencia de grado térmico).
Normalmente suele darse en los sólidos, desde una zona de temperatura superior a una inferior, se caracteriza por ser lenta y la mayor o menor velocidad de propagación dependerá de la estructura y naturaleza de las sustancias.
Normalmente suele darse en los sólidos, desde una zona de temperatura superior a una inferior, se caracteriza por ser lenta y la mayor o menor velocidad de propagación dependerá de la estructura y naturaleza de las sustancias.
Calor por Convección:
Transmisión de calor entre una superficie y un cuerpo que se desplaza hacia ella.
Se da en líquidos y gases, es decir, se efectúa por la mezcla de moléculas de un fluido con el cuerpo del fluido, por contacto intimo con una superficie caliente o fría.
El fluido caliente se dilata y eleva, pasando el fluido frío a la parte inferior y generándose una corriente ascendente.
Se da en líquidos y gases, es decir, se efectúa por la mezcla de moléculas de un fluido con el cuerpo del fluido, por contacto intimo con una superficie caliente o fría.
El fluido caliente se dilata y eleva, pasando el fluido frío a la parte inferior y generándose una corriente ascendente.
Calor por Radiación:
No necesita medio material para transmitir el calor, se produce por la propagación del calor en forma de ondas magnéticas, es decir, por transferencia de calor de un cuerpo a otro, sin que la materia interpuesta debilite el fenómeno.
La radiación se propaga en línea recta y en todas las direcciones.
La radiación se propaga en línea recta y en todas las direcciones.
2. CONCEPTO DE TEMPERATURA (t)
La temperatura es una propiedad física del estado de los cuerpos, es decir el mayor o menor grado térmico (de calor) de los cuerpos.
El calor siempre fluye de mayor a menor temperatura, de la misma forma que cuanto más caliente está un cuerpo, más elevada es su temperatura.
Al poder determinarse como una sensación térmica, palpable por el sentido del tacto, podemos apreciar la manifestación de cuando un cuerpo está más caliente que otro e incluso medir por determinación del paso de calor de un cuerpo a otro.
Para poder medirla se utilizan los termómetros, existiendo en la actualidad diferentes escalas termométricas (centígrada, Réaumur, Fahrenheit, Kelvin, etc...).
El calor siempre fluye de mayor a menor temperatura, de la misma forma que cuanto más caliente está un cuerpo, más elevada es su temperatura.
Al poder determinarse como una sensación térmica, palpable por el sentido del tacto, podemos apreciar la manifestación de cuando un cuerpo está más caliente que otro e incluso medir por determinación del paso de calor de un cuerpo a otro.
Para poder medirla se utilizan los termómetros, existiendo en la actualidad diferentes escalas termométricas (centígrada, Réaumur, Fahrenheit, Kelvin, etc...).
3. DIFERENCIA ENTRE CALOR Y TEMPERATURA
Podemos decir que el calor es una energía, debida a la iteración de las moléculas de la materia, mientras que la temperatura es una manifestación del grado de calor que alcanzan los cuerpos (estado térmico de los cuerpos), magnitud discreta. Cuando se aplica calor a un material, el principal efecto que se observa en él, es un cambio de temperatura.
La temperatura es una variable termodinámica de estado condicionada al nivel calorífico que posee el cuerpo.
La temperatura será la medida de su calentamiento, no la cantidad de calor en él. Por ejemplo si tenemos dos cuerpos en una mismo habitáculo (un metal y un trozo de madera) que se encuentra a una temperatura fija, ambos cuerpos estarán a la misma temperatura (la del habitáculo), sin embargo al tocar el metal notaremos una mayor sensación de frío que en la madera, justificable porque la madera es capaz por su naturaleza absorber más calor que el metal.
La temperatura es una variable termodinámica de estado condicionada al nivel calorífico que posee el cuerpo.
La temperatura será la medida de su calentamiento, no la cantidad de calor en él. Por ejemplo si tenemos dos cuerpos en una mismo habitáculo (un metal y un trozo de madera) que se encuentra a una temperatura fija, ambos cuerpos estarán a la misma temperatura (la del habitáculo), sin embargo al tocar el metal notaremos una mayor sensación de frío que en la madera, justificable porque la madera es capaz por su naturaleza absorber más calor que el metal.
4. ESCALAS DE TEMPERATURA
Una escala termométrica se define estableciendo una relación entre la magnitud variable elegida y la temperatura, convencionalmente se eligen dos puntos fijos como base de la escala. Estos dos puntos coinciden con fenómenos fijos que se materializan siempre a la misma temperatura y condiciones normales (como por ejemplo la fusión y ebullición del agua a presión atmosférica normal).
El intervalo de separación de estas dos temperaturas t1 y t2 se llama intervalo fundamental. Debido a que una escala termométrica, puede fijarse por diferentes criterios, en principio nacieron diversas escalas de medición.
En 1948, el comité internacional de pesos y medidas, acordó que toda escala termométrica de medición de la temperatura debería corregirse para ser adoptada al grado escogido como legal.
Hoy en día existen tres escalas más o menos utilizadas (centígrada o Celsius, Réaumur - en desuso - y Fahrenheit), más otra utilizada en entornos científicos (kelvin).
Dichas escalas comparten en principio los mismos puntos de referencia, fusión y ebullición del agua, pero lo que las distinguen entre sí, son los diferentes criterios de aplicación para la división de la escala en partes iguales, con referencia al intervalo fundamental. Siendo denotadas con el símbolo del grado seguido de la inicial de cada uno de los nombres de la escala, correspondiendo:
El intervalo de separación de estas dos temperaturas t1 y t2 se llama intervalo fundamental. Debido a que una escala termométrica, puede fijarse por diferentes criterios, en principio nacieron diversas escalas de medición.
En 1948, el comité internacional de pesos y medidas, acordó que toda escala termométrica de medición de la temperatura debería corregirse para ser adoptada al grado escogido como legal.
Hoy en día existen tres escalas más o menos utilizadas (centígrada o Celsius, Réaumur - en desuso - y Fahrenheit), más otra utilizada en entornos científicos (kelvin).
Dichas escalas comparten en principio los mismos puntos de referencia, fusión y ebullición del agua, pero lo que las distinguen entre sí, son los diferentes criterios de aplicación para la división de la escala en partes iguales, con referencia al intervalo fundamental. Siendo denotadas con el símbolo del grado seguido de la inicial de cada uno de los nombres de la escala, correspondiendo:
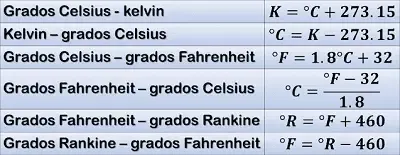
La relación que une las escalas entre sí, para una misma temperatura, de forma que se pueden realizar los cálculos de paso de una escala a otra, indistintamente, es la siguiente:
Escala Celsius
También llamada centígrada o centesimal, es la de uso más general, su intervalo fundamental hace coincidir el valor 0, al estado térmico del hielo fundente, y el valor 100, con el vapor de agua en ebullición.
Se basa en que dichos fenómenos se producen siempre a la misma temperatura, con condiciones de presión y otras normales.
La escala se divide en 100 partes iguales (grados), las temperaturas por debajo de 0ºC se consideran negativas (bajo cero).
Todo ello se refiere al termómetro patrón (termómetro de gas perfecto, variaciones de un gas perfecto de volumen constante, ecuación gases perfectos: p v = n r t ; donde "p" es la presión en atm, "v" el volumen en litros, "n" es el número de moles, "r" es la cte.
Gases perfectos y que vale 0,082, y "t" es la temperatura dada en ºk) debido a que el valor térmico depende de la naturaleza de la sustancia.
Se basa en que dichos fenómenos se producen siempre a la misma temperatura, con condiciones de presión y otras normales.
La escala se divide en 100 partes iguales (grados), las temperaturas por debajo de 0ºC se consideran negativas (bajo cero).
Todo ello se refiere al termómetro patrón (termómetro de gas perfecto, variaciones de un gas perfecto de volumen constante, ecuación gases perfectos: p v = n r t ; donde "p" es la presión en atm, "v" el volumen en litros, "n" es el número de moles, "r" es la cte.
Gases perfectos y que vale 0,082, y "t" es la temperatura dada en ºk) debido a que el valor térmico depende de la naturaleza de la sustancia.
Escala absoluta
La escala Celsius da temperaturas negativas para grados por debajo de la temperatura del hielo en fusión, por ello necesitamos alguna escala que nos ofrezca todo el rango de temperaturas de una materia en función de un valor de referencia y que sean siempre expresadas en números positivos.
Por ello, al estudiar el termómetro de gas perfecto (patrón) las variaciones de presión del gas cuando la temperatura media disminuye, nos presenta una reducción de la presión de (1 : 273,15) de su valor por cada grado Celsius que la temperatura disminuye.
Entonces cuando se alcanzan los 273,15ºC de índice, la presión no puede disminuir más quedando nula, con lo cual 273,15ºC es el punto por debajo del cual, no puede descender la temperatura, por ello se le denomina el cero absoluto y da origen a la escala kelvin.
Como la escala kelvin esta dividida en cien partes iguales al igual que la escala Celsius, la relación de conversión será la siguiente: tºk = tºc + 273,15ºc.
Por ello, al estudiar el termómetro de gas perfecto (patrón) las variaciones de presión del gas cuando la temperatura media disminuye, nos presenta una reducción de la presión de (1 : 273,15) de su valor por cada grado Celsius que la temperatura disminuye.
Entonces cuando se alcanzan los 273,15ºC de índice, la presión no puede disminuir más quedando nula, con lo cual 273,15ºC es el punto por debajo del cual, no puede descender la temperatura, por ello se le denomina el cero absoluto y da origen a la escala kelvin.
Como la escala kelvin esta dividida en cien partes iguales al igual que la escala Celsius, la relación de conversión será la siguiente: tºk = tºc + 273,15ºc.
Resto escalas
Para conversión del resto escalas a la escala absoluta, primero hay que adoptar los grados centesimales o aplicar la conversión directamente en la formula de equivalencias anteriormente citada.
5. MEDICIÓN DE TEMPERATURA: TERMÓMETROS
La temperatura se define o mide por números relativos, dependiente del inicio y final del rango que delimita el intervalo fundamental y la subdivisión adoptada para dicho intervalo.
La medición precisa de la magnitud temperatura se realiza por medio de los termómetros, que para la graduación térmica se utilizan aparatos de poca masa para hacer más asequible las comparaciones.
Su principio se basa en el hecho que muchas de las propiedades de los cuerpos se modifican al variar la temperatura. Una de ellas, fácilmente observable es el volumen, de ahí que la mayoría de los termómetros estén basados en la observación del volumen de un líquido o gas, y como sabemos este está en función de la densidad y masa del mismo (v = m/d).
La medición precisa de la magnitud temperatura se realiza por medio de los termómetros, que para la graduación térmica se utilizan aparatos de poca masa para hacer más asequible las comparaciones.
Su principio se basa en el hecho que muchas de las propiedades de los cuerpos se modifican al variar la temperatura. Una de ellas, fácilmente observable es el volumen, de ahí que la mayoría de los termómetros estén basados en la observación del volumen de un líquido o gas, y como sabemos este está en función de la densidad y masa del mismo (v = m/d).
Existen diversos tipos de termómetros, viendo aquí algunos de ellos:
Termómetros de dilatación de líquidos
Es el instrumento más sencillo y corriente, consiste en un pequeño tubo de vidrio cerrado y graduado.
Sirve de indicador la longitud de una columna de mercurio o alcohol, contenido en el mismo. Al ser sustancias sensibles a las variaciones térmicas, como por ejemplo el mercurio que al estar encerrado en un tubo aumenta de nivel cuando se dilata por efecto del calor, lo cual nos permite medir la temperatura al ascender cuando se calienta y descender cuando se enfría.
La solidificación del mercurio se produce a -39ºC y la ebullición a 357ºC, por ello normalmente para efectuar una nueva temperatura en los termómetros clínicos se sacuden, para que el mercurio vuelva a su posición original. Existen otras sustancias para medir temperaturas muy bajas, como el alcohol de tolueno y el pentano.
Sirve de indicador la longitud de una columna de mercurio o alcohol, contenido en el mismo. Al ser sustancias sensibles a las variaciones térmicas, como por ejemplo el mercurio que al estar encerrado en un tubo aumenta de nivel cuando se dilata por efecto del calor, lo cual nos permite medir la temperatura al ascender cuando se calienta y descender cuando se enfría.
La solidificación del mercurio se produce a -39ºC y la ebullición a 357ºC, por ello normalmente para efectuar una nueva temperatura en los termómetros clínicos se sacuden, para que el mercurio vuelva a su posición original. Existen otras sustancias para medir temperaturas muy bajas, como el alcohol de tolueno y el pentano.
Termómetros de gas
Determinan la temperatura a volumen constante y a presión constante, siendo más sensible el primero, por ello se utiliza más el de volumen constante.
La propiedad que lo rige es la siguiente: el volumen de un gas es constante, paralelo a la temperatura. Si ésta aumenta lo hará a su vez la presión de forma proporcional. El intervalo de estos termómetros es de -250 a 1000ºC, de mayor sensibilidad que los de mercurio, coeficiente de dilatación de los gases es mayor.
No tiene aplicaciones industriales y son empleados en el campo científico. Los gases principales utilizados son: hasta 200ºC el helio, entre 200-300ºC el hidrógeno y superiores a 300ºC el nitrógeno. Normalmente suele encerrarse en vidrio, al igual que el mercurio, pero para temperaturas mayores de 500ºC se sustituye por platino.
La propiedad que lo rige es la siguiente: el volumen de un gas es constante, paralelo a la temperatura. Si ésta aumenta lo hará a su vez la presión de forma proporcional. El intervalo de estos termómetros es de -250 a 1000ºC, de mayor sensibilidad que los de mercurio, coeficiente de dilatación de los gases es mayor.
No tiene aplicaciones industriales y son empleados en el campo científico. Los gases principales utilizados son: hasta 200ºC el helio, entre 200-300ºC el hidrógeno y superiores a 300ºC el nitrógeno. Normalmente suele encerrarse en vidrio, al igual que el mercurio, pero para temperaturas mayores de 500ºC se sustituye por platino.
Termometría industrial
Debido a que en la industria se alcanzan usualmente temperaturas muy elevadas (por encima de los 1000ºC, llegando incluso a los 3000ºC) los termómetros anteriormente citados poseen limitaciones. Por ello se usan habitualmente otros tipos de termómetros, dependiendo de la exactitud necesaria, como:
- termómetros bimetálicos: 50-1000ºC, errores del 2%
- termómetros de resistencia eléctrica: 250-1000ºC, exactitud de 0,01-0,1ºC
- termómetros de par termoeléctrico: 200-2000ºC, sensibilidad del 2-10ºC
- pirómetros ópticos de radiación: 700-3000ºC, errores del 0,5-2%
6. ESTRUCTURA ATÓMICA DE LA MATERIA
Cada clase de materia está constituida de átomos (parte elemental) de diferente índole que sin embargo todos ellos tienen una estructura atómica semejante y que para entenderla podemos compararla con el sistema planetario que posee nuestro sistema solar, es decir los átomos constan de dos partes principales:
Núcleo atómico
Que tiene una estructura compacta y esta constituido por dos tipos de partículas: protones (con masa y carga positiva) y neutrones (con masa y sin carga, es decir neutra).
Corteza o nube electrónica
Que esta compuesta de partículas muy pequeñas llamadas electrones (con carga negativa y prácticamente sin masa), los cuales se distribuyen en orbitales y giran alrededor del núcleo.
A pesar de poder diferenciar claramente dicha estructura, los átomos no se disgregan fácilmente en sus partículas constituyentes (protones, neutrones y electrones) gracias al equilibrio de fuerzas originadas entre el núcleo y la nube electrónica, más concretamente, entre los protones y electrones que son de igual número y de cargas de signo contrario.
Como la tabla periódica posee 105 elementos y estos son estructuralmente diferentes, cada uno de ellos se distingue de los otros por poseer diferente número de partículas (protones, neutrones y electrones).
A pesar de poder diferenciar claramente dicha estructura, los átomos no se disgregan fácilmente en sus partículas constituyentes (protones, neutrones y electrones) gracias al equilibrio de fuerzas originadas entre el núcleo y la nube electrónica, más concretamente, entre los protones y electrones que son de igual número y de cargas de signo contrario.
Como la tabla periódica posee 105 elementos y estos son estructuralmente diferentes, cada uno de ellos se distingue de los otros por poseer diferente número de partículas (protones, neutrones y electrones).
Numero atómico de un elemento
Es el numero de protones que posee y que como hemos visto coincide a su vez con el número de electrones (carga contraria) y de neutrones.
Peso atómico
Se denomina al número de veces que un átomo es más pesado que la doceava parte del átomo de carbono (peso del carbono es 12).
Peso molecular
De un compuesto es la suma de los pesos atómicos de todos los átomos que constituyen la molécula.
Molécula-gramo (mol)
Es la cantidad de sustancia cuyo peso expresado en gramos es igual numéricamente a su peso molecular.
Como se ha comentado los electrones se sitúan en capas (llamadas orbitales), de forma que cada capa contiene un número concreto de electrones, el número de electrones que están situados en la capa más externa da la capacidad de reactividad del átomo (afinidad). Es decir los átomos tienden a estabilizarse, ser semejantes a los gases nobles, los cuales tienen ocho electrones en la última capa entonces los átomos tenderán a alcanzar dicho estado de equilibrio cediendo, ganando o compartiendo electrones.
Como se ha comentado los electrones se sitúan en capas (llamadas orbitales), de forma que cada capa contiene un número concreto de electrones, el número de electrones que están situados en la capa más externa da la capacidad de reactividad del átomo (afinidad). Es decir los átomos tienden a estabilizarse, ser semejantes a los gases nobles, los cuales tienen ocho electrones en la última capa entonces los átomos tenderán a alcanzar dicho estado de equilibrio cediendo, ganando o compartiendo electrones.
Enlace químico
Es pues la fuerza de atracción entre los átomos y provistas de tal intensidad que permite las agrupaciones atómicas como unidades, pudiendo distinguir: enlace iónico y covalente.
Radicales
Son agrupaciones atómicas o componentes de moléculas, que en presencia de reacciones químicas permanecen generalmente indiferentes e invariables, es decir aislados.
Por ello, se denomina radical libre al fragmento molecular o atómico que posee uno o más electrones desapareado, por ello su existencia es breve y puede provocar reacciones de mecanismo en cadena.
Un elemento químico se denomina al número de electrones que pierde, gana o comparte un átomo para conseguir la estructura del gas noble más cercano en la tabla periódica. Es decir, representa el poder de combinación de un elemento con otro.
TEMA DISPONIBLE EN ARCHIVO PDF
"Recuerda enviar el formulario al final de la página"
Por ello, se denomina radical libre al fragmento molecular o atómico que posee uno o más electrones desapareado, por ello su existencia es breve y puede provocar reacciones de mecanismo en cadena.
Un elemento químico se denomina al número de electrones que pierde, gana o comparte un átomo para conseguir la estructura del gas noble más cercano en la tabla periódica. Es decir, representa el poder de combinación de un elemento con otro.
"Recuerda enviar el formulario al final de la página"